|
정부의 약가 인하 정책이 환자의 신약 접근성은 물론 연구개발(R&D) 경쟁력을 떨어뜨리고 있다는 지적이 나왔다. 이에 다양한 사회적 가치를 반영한 건강보험 의약품 정책 방향 수립이 필요하다는 것이 전문가들의 견해다.
유승래 동덕여대 교수는 6일 한국제약바이오협회에서 ‘보험약가 정책 국내 현황, 외국 사례 및 향후 발전방향 중심으로’를 주제로 한 강연에서 “글로벌 시장에 출시된 약제가 국내에서 오랜 기간 출시는커녕 허가조차 받지 않는 것은 국내 급여 정책이나 사용 환경에 우려가 있기 때문”이라고 말했다.
유 교수에 따르면 글로벌 시장 최초 출시 후 1년 이내 국내 출시된 신약의 비율은 5%에 불과했다. 미국(78%), 독일(44%), 영국(38%) 등 이 비율이 높은 국가뿐 아니라 경제협력개발기구(OECD) 평균도 18%인 것에 비해 저조한 수치다. 그만큼 국내 환자들의 신약 접근성이 떨어진다는 뜻이다.
해외 오리지널 신약이 국내에서 상업화를 포기해 한참이 지나서야 국산 제네릭 의약품(복제약)이 국내에 먼저 등재되는 경우도 있다. 화이자의 폐동맥고혈압 치료제 ‘레바티오’가 2007년에 허가를 받았으나 한미약품(128940)의 제네릭인 ‘파텐션’이 2013년에 먼저 국내 출시된 것이 대표적이다. 반대로 동아에스티(170900)의 ‘시벡스트로’, SK바이오팜(326030)의 ‘엑스코프리’는 우리 기업이 개발했으나 국내에는 출시하지 않고 해외 시장에만 출시한 사례다.
이는 국내 제도에 기인한다는 것이 유 교수의 분석이다. 우리나라에서는 2007년 ‘선별등재 방식(Positive List)’ 도입 이후 △대체 가능 약제 유무 △임상적 유용성 △비용 효과성 등을 고려해 신약 가격을 협상하게 된다. 하지만 이때 각종 수치와 관련해 업계와 보험당국 간 입장 차이가 큰 데다 당국에서는 혁신성이나 환자의 약물 접근성 향상 등을 약가에 반영하지 않는다는 문제가 있다.
이는 기업의 신약 R&D 유인 저하로도 이어진다. 유 교수가 인용한 미국 연구에 따르면 새로운 가격 규제가 도입됐을 때 R&D 투자는 23.4~32.7% 감소하고 약가가 50% 하락할 경우 R&D 파이프라인이 14~24% 줄어들 것으로 예상됐다. 미국이 2019~2021년 약가 규제 관련 법안(H.R.3) 도입을 논의할 당시 업계 수익 감소에 따라 2039년까지 R&D가 60% 감소하고 342개 신약 파이프라인에 차질이 발생할 것이란 전망도 나왔다.
유 교수는 “환자 접근성, 재정 효율화, 혁신산업 생태계 등 다양한 사회적 가치를 반영한 건강보험 의약품 정책 방향이 필요하다”며 “기존 약제보다 질환·성분·제제 특성상 추가 편익이 기대되는 신약이 합리적인 가격으로 상업화될 수 있도록 신약 평가 시 가치 평가를 세분화하고 환급형 계약 등을 활용하는 쪽으로 제도가 설계돼야 한다”고 조언했다.
|








 박효정 기자
박효정 기자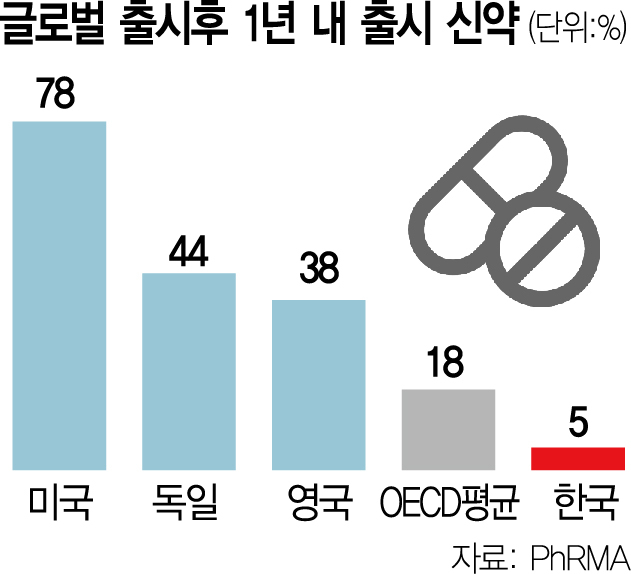















![학폭의혹 김유진PD·강승현 '사실을 떠나' 사과or반박, 모두 '후폭풍' [SE★이슈]](https://img.sedaily.com/Web/Level/2020/04/1Z1L47NQVD_GL_119686_m.jpeg)
![[SE★현장] 최강희X김지영X유인영 '굿캐스팅'? 아니죠 "레전드 캐스팅입니다"(종합)](https://img.sedaily.com/Web/Level/2020/04/1Z1KOPGULE_GL_119657_m.jpeg)



![[Mr.쓴샤인]'본 어게인'이 '본 어게인' 해야 할 것 같은데](https://img.sedaily.com/Web/Level/2020/04/1Z1K929W93_GL_119628_m.jpg)
![[SE★현장]'K-밥 스타' 김숙X이영자 "다이어트에 지친 아이돌, 우리에게 오라"(종합)](https://img.sedaily.com/Web/Level/2020/04/1Z1K8NFPJQ_GL_119626_m.jpeg)
!["6만6천원에 모십니다" 은퇴 번복 박유천, 팬클럽 가입비·화보집 논란[SE★이슈]](https://img.sedaily.com/Web/Level/2020/04/1Z1K89DCS9_GL_119627_m.jpeg)

![[SE★VIEW]'더 킹-영원의 군주' 출발은 약했다…'김은숙의 힘' 입증할까](https://img.sedaily.com/Web/Level/2020/04/1Z1JSH2I25_GL_119582_m.jpg)
![[SE★현장]'본 어게인' 진세연 "대본 아니라 소설 읽는 느낌, 너무 재미있었다"](https://img.sedaily.com/Web/Level/2020/04/1Z1JSG1C28_GL_119585_m.jpeg)

!["가방사주면 애인해줘?" 언제적 이야기…'부부의 세계' 폭행·성성품화 논란 [SE★이슈]](https://img.sedaily.com/Web/Level/2020/04/1Z1JR617X9_GL_119571_m.jpg)





















