|
허가받지 않은 세포가 의약품에 함유됐다는 사실이 알려진 퇴행성 관절염 치료제 ‘인보사’를 투여한 환자들의 손해배상 집단 소송 움직임이 가속화되고 있다.
8일 관련업계에 따르면 법무법인 오킴스가 코오롱생명과학을 상대로 소송을 제기할 인보사 투여 환자를 모집한 결과, 전날 기준 소송 참여 의사를 밝힌 환자는 110여명으로 집계됐다. 인보사 논란이 터진 직후부터 오킴스는 약사법에 근거해 코오롱생명과학에 책임을 물어야 한다고 주장해왔다. 약사법에 따르면 의약품 제조·판매사는 허가 또는 신고된 의약품으로 그 성분 또는 분량이 허가된 내용과 다른 의약품을 판매하거나 판매 목적으로 제조하면 안 된다고 규정하고 있다.
오킴스 외에도 여러 법무법인들이 나서 소송에 참여할 환자를 모집하고 있다. 국내에서 인보사를 투여받은 환자는 지금까지 총 3,707명이다.
인보사는 사람 연골세포(HC)가 담긴 1액과 연골세포 성장인자(TGF-β1)를 도입한 형질전환세포(TC)가 담긴 2액으로 구성된 주사제다. 코오롱생명과학의 자회사인 코오롱티슈진이 개발했고 지난 2017년 코오롱생명과학이 식품의약품안전처로부터 국내 첫 유전자치료제로 허가받았다. 최근 2액의 형질전환세포가 허가 당시 제출한 자료에 기재된 연골세포가 아닌 신장세포(293유래세포)로 드러나 논란이 일었다.
/이종호기자 phillies@sedaily.com








 이종호 기자
이종호 기자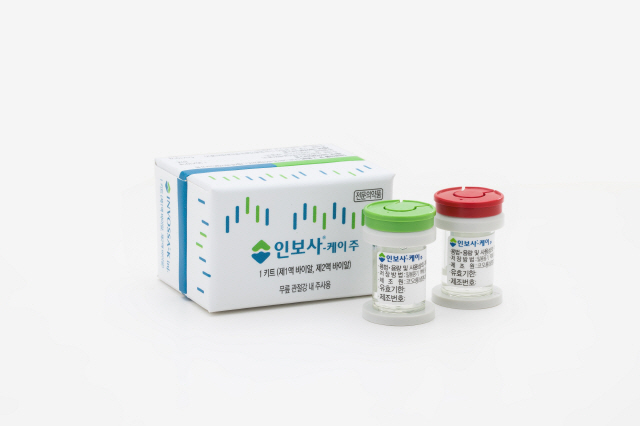














![학폭의혹 김유진PD·강승현 '사실을 떠나' 사과or반박, 모두 '후폭풍' [SE★이슈]](https://img.sedaily.com/Web/Level/2020/04/1Z1L47NQVD_GL_119686_m.jpeg)
![[SE★현장] 최강희X김지영X유인영 '굿캐스팅'? 아니죠 "레전드 캐스팅입니다"(종합)](https://img.sedaily.com/Web/Level/2020/04/1Z1KOPGULE_GL_119657_m.jpeg)



![[Mr.쓴샤인]'본 어게인'이 '본 어게인' 해야 할 것 같은데](https://img.sedaily.com/Web/Level/2020/04/1Z1K929W93_GL_119628_m.jpg)
![[SE★현장]'K-밥 스타' 김숙X이영자 "다이어트에 지친 아이돌, 우리에게 오라"(종합)](https://img.sedaily.com/Web/Level/2020/04/1Z1K8NFPJQ_GL_119626_m.jpeg)
!["6만6천원에 모십니다" 은퇴 번복 박유천, 팬클럽 가입비·화보집 논란[SE★이슈]](https://img.sedaily.com/Web/Level/2020/04/1Z1K89DCS9_GL_119627_m.jpeg)

![[SE★VIEW]'더 킹-영원의 군주' 출발은 약했다…'김은숙의 힘' 입증할까](https://img.sedaily.com/Web/Level/2020/04/1Z1JSH2I25_GL_119582_m.jpg)
![[SE★현장]'본 어게인' 진세연 "대본 아니라 소설 읽는 느낌, 너무 재미있었다"](https://img.sedaily.com/Web/Level/2020/04/1Z1JSG1C28_GL_119585_m.jpeg)

!["가방사주면 애인해줘?" 언제적 이야기…'부부의 세계' 폭행·성성품화 논란 [SE★이슈]](https://img.sedaily.com/Web/Level/2020/04/1Z1JR617X9_GL_119571_m.jpg)





















